থমসন এবং রাদারফোর্ড মডেলের পার্থক্য এটম। টমসন বনাম রাদারফোর্ড মডেলের এটম
কী পার্থক্য - থমসন বনাম রাদারফোর্ড মডেলের অ্যাটম
থমসন এবং রাদারফোর্ড মডেলের পারমাণবিক শক্তি পারমাণবিক শক্তিগুলির পার্থক্য হল যে পরমাণুর থমসন মডেলের নিউক্লিয়াস যখন পরমাণু রাদারফোর্ড মডেল একটি পরমাণুর নিউক্লিয়াস সম্পর্কে ব্যাখ্যা করে। জে। জে। থমসন প্রথম আবিষ্কার করেছিলেন যা 1904 সালে ইলেকট্রন নামক উপাত্তিক কণাটি আবিষ্কার করেছিল। তিনি প্রস্তাবিত মডেলটি 'এটম এর প্লাম পুডিং মডেল' নামে নামকরণ করা হয়েছিল। কিন্তু 1 9 11 সালে, আর্নেস্ট রাদারফোর্ড 1909 সালে পারমাণবিক নিউক্লিয়াস আবিষ্কারের পর পরমাণুর জন্য একটি নতুন মডেল নিয়ে এসেছিলেন।
সুচিপত্র
1। সংক্ষিপ্ত বিবরণ এবং কী পার্থক্য
2 এটম এর থমসন মডেল কি?
3 অটো রাদারফোর্ড মডেল
4 পার্শ্ব তুলনা দ্বারা সাইড - টেম্পোর ফর্ম <3২ 99 5 এ থমসন বনাম রাদারফোর্ড মডেলের অ্যাটম সারাংশ
এএমএম এর থমসন মডেল কি?
পরমাণুর থমসন মডেলকে
প্লাম পুডিং মডেল বলা হয় কারণ এটি বলে যে পরমাণু একটি প্লাম পুডির মত দেখাচ্ছে। ঐ সময়ে পরমাণু সম্পর্কে শুধুমাত্র পরিচিত বিবরণ ছিল,
- ইলেক্ট্রনগুলি নেতিবাচক ভাবে চার্জযুক্ত কয়গুলি
- পরমাণুগুলি নিরপেক্ষভাবে চার্জযুক্ত হয়
- ইলেকট্রনগুলি নেগেটিভভাবে চার্জ করার কারণে, থমসন এই প্রস্তাব দেয় যে, একটি ইতিবাচক চার্জ থাকতে হবে পরমাণুর বৈদ্যুতিক চার্জ নিরপেক্ষ। পরমাণুটির থমসন মডেলটি ব্যাখ্যা করে যে ইলেকট্রন একটি ইতিবাচক চার্জযুক্ত উপাদান যা এন্ডের আকারের গোলাকার হয়। এই কাঠামোটি প্লাবনের সাথে একটি পুডিং এর মত সংযুক্ত এবং এটম এর প্লাম পুডিং মডেল নামে নামকরণ করা হয়। এই অনুমানটি প্রমাণিত হয়েছে যে একটি পরমাণু নিরপেক্ষভাবে অভিযুক্ত করা হয় যেহেতু এই মডেলটি ইলেকট্রনগুলির নেতিবাচক অভিযোগগুলিকে কঠিন গোলকের ইতিবাচক চার্জ দ্বারা নিরপেক্ষ বলে অভিহিত করে। যদিও এই মডেল প্রমাণ করে যে পরমাণু নিরপেক্ষভাবে চার্জ করা হয়, নিউক্লিয়াস আবিষ্কারের পর এটি প্রত্যাখ্যাত হয়েছিল।

অটোর রাদারফোর্ড মডেল কি?
পরমাণুর রাদারফোর্ড মডেল অনুযায়ী, তথাকথিত থমসন এর প্লাম পুডিং মডেল ভুল ছিল। পরমাণুর রাদারফোর্ড মডেলকে
পারমাণবিক মডেল বলা হয় কারণ এটি একটি পরমাণুর নিউক্লিয়াস সম্পর্কে বিস্তারিত প্রদান করে। "রাদারফোর্ড সোনার ফয়েল পরীক্ষা" নামক বিখ্যাত পরীক্ষাটি নিউক্লিয়াস আবিষ্কারের দিকে পরিচালিত করেছিল। এই পরীক্ষায়, আলফা কণা একটি স্বর্ণ ফয়েল মাধ্যমে বোমা; তারা সোনা ফয়েল দ্বারা সোজা যেতে আশা করেছিল কিন্তু সরাসরি অনুপ্রবেশের পরিবর্তে, আলফা কণা বিভিন্ন দিকের দিকে অগ্রসর হয়।
চিত্র 02: রাদারফোর্ড গোল্ড ফয়েল পরীক্ষা
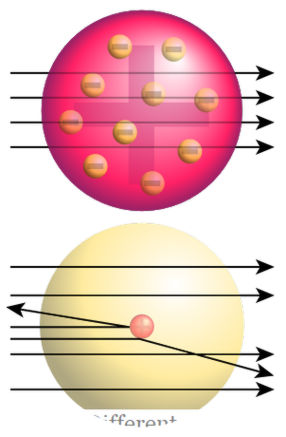
শীর্ষ: প্রত্যাশিত ফলাফল (স্ট্রেইট অনুপ্রবেশ) নীচে : পর্যবেক্ষিত ফলাফল (কিছু কণার ডিফেক্টেশন) এটি নির্দেশ করে যে কিছু কঠিন যে সোনা ফয়েল মধ্যে একটি ইতিবাচক চার্জ সঙ্গে যা আলফা কণা সঙ্গে একটি সংঘর্ষের কারণ রাদারফোর্ড নিউক্লিয়াস হিসাবে এই ইতিবাচক কোর নামকরণ। তারপর তিনি পরমাণু জন্য পারমাণবিক মডেল প্রস্তাব; এটি একটি ইতিবাচক চার্জযুক্ত নিউক্লিয়াস এবং নিউক্লিয়াস ঘিরে নেতিবাচকভাবে অভিযুক্ত ইলেক্ট্রনগুলির গঠিত ছিল। তিনি আরও পরামর্শ দেন যে ইলেক্ট্রনগুলি নির্দিষ্ট দূরত্বের মধ্যে নিউক্লিয়াসের চারপাশে অবাঞ্ছিত। এই মডেলটিকে
গ্রহের মডেল বলা হয় কারণ রাদারফোর্ড সূত্রের চারপাশের চারপাশে থাকা গ্রহগুলোর মত ইলেকট্রন নিউক্লিয়াসের চারপাশে অবস্থিত বলে প্রস্তাব করেছেন। এই মডেল অনুযায়ী, পরমাণু একটি ইতিবাচক চার্জ কেন্দ্র যা নিউক্লিয়াস বলা হয় গঠিত হয়। এই কেন্দ্রটিতে পারমাণবিক ভর ভর ছিল।
- ইলেকট্রন নিউক্লিয়াসের বাইরের বাইরে অবস্থিত একটি বিশাল দূরত্বের মধ্যে অবস্থিত।
- ইলেকট্রন সংখ্যা নিউক্লিয়াসে ইতিবাচক চার্জ সংখ্যা (পরবর্তীতে প্রোটন) বলে সমান হয়।
- পরমাণুর আয়তন তুলনা করলে নিউক্লিয়াসের আয়তন অপ্রত্যাশিত হয়। অতএব, পরমাণুর অধিকাংশ স্থান ফাঁকা।
- যাইহোক, এই পরমাণুর রাদারফোর্ড মডেলটিও প্রত্যাখ্যাত হয়েছিল কারণ নিউক্লিয়াসের ইলেকট্রন এবং ইতিবাচক চার্জ একে অপরের কাছে আকৃষ্ট হয় না কারণ এটি ব্যাখ্যা করতে পারে না।
চিত্র 03: রটারফোর্ড মডেলের অ্যাটম

থমসন ও রাদারফোর্ড মডেলের পারমাণবিক পার্থক্য কি?
- টেবিল থেকে ডিফ্রএফ আর্টিলার মধ্যম ->
থমসন বনাম রটারফোর্ড মডেলের অ্যাটম
পারমাণবিক থমসন মডেলটি মডেলটি বলে যে ইলেকট্রন একটি ইতিবাচক চার্জযুক্ত উপাদান যা এন্ডের আকারের গোলাকার আকারে রয়েছে। |
|
| পরমাণুর রাদারফোর্ড মডেল হল মডেল যা ব্যাখ্যা করে যে নিউক্লিয়াসের চারপাশে পরমাণু এবং ইলেকট্রনের কেন্দ্রস্থলে একটি নিউক্লিয়াস রয়েছে। | নিউক্লিয়াস |
| পরমাণুর থমসন মডেল নিউক্লিয়াস সম্পর্কে কোন বিস্তারিত বিবরণ দেয় না। | |
| পরমাণুর রাদারফোর্ড মডেলটি পরমাণুর নিউক্লিয়াস এবং পরমাণুর ভিতরের অবস্থান সম্পর্কে বিস্তারিত বিবরণ দেয়। | ইলেকট্রন অবস্থান |
| পরমাণু থমসন মডেল অনুযায়ী, ইলেকট্রন একটি কঠিন উপাদান মধ্যে এমবেড করা হয়। | |
| রাদারফোর্ড মডেল বলছেন ইলেকট্রন নিউক্লিয়াসের চারপাশে অবস্থিত। | অরবিটস |
| পরমাণুর থমসন মডেল অরবিটালের বিবরণ দেয় না। | |
| পরমাণুর রাদারফোর্ড মডেল অরবিটাল সম্পর্কে ব্যাখ্যা করে এবং এই ইলেকট্রনগুলি এই অক্ষাংশে অবস্থিত। | ভর |
| পরমাণুটির থমসন মডেল ব্যাখ্যা করে যে, একটি পরমাণুর ভর হল ইতিবাচকভাবে চার্জযুক্ত সমান যেখানে ইলেক্ট্রনগুলি এমবেড করা হয়। | |
| পরমাণু রাদারফোর্ড মডেল অনুযায়ী, একটি পরমাণুর ভর পারমাণবিক নিউক্লিয়াসে কেন্দ্রীভূত হয়। | সংক্ষিপ্ত বিবরণ - থমসন বনাম রাদারফোর্ড মডেলের অটোম |
থমসন ও রাদারফোর্ড মডেলের পরমাণুগুলি একটি পরমাণুর গঠন ব্যাখ্যা করার সবচেয়ে পুরনো মডেল ছিল। জে। থমসন দ্বারা ইলেক্ট্রনের আবিষ্কারের পর, তিনি পরমাণুর গঠন ব্যাখ্যা করার জন্য একটি মডেল প্রস্তাব করেছিলেন। পরে, রাদারফোর্ড নিউক্লিয়াস আবিষ্কৃত এবং একটি নতুন মডেল উভয় ইলেক্ট্রন এবং নিউক্লিয়াস ব্যবহার করে। পরমাণুর থমসন এবং রাদারফোর্ড মডেলের মধ্যে প্রধান পার্থক্য হলো পরমাণুর থমসন মডেলের নিউক্লিয়াস সম্পর্কে কোন বিবরণ নেই তবে পারমাণবিক নিউট্রিয়াসের পরমাণুর রাদারফোর্ড মডেলটি ব্যাখ্যা করে।
থমসন বনাম রাদারফোর্ড মডেলের পিডিএফ সংস্করণটি ডাউনলোড করুন
আপনি এই প্রবন্ধের পিডিএফ সংস্করণটি ডাউনলোড করতে পারেন এবং বিবৃতি নোটগুলি অনুযায়ী অফলাইন উদ্দেশ্যে এটি ব্যবহার করতে পারেন। এখানে পিডিএফ সংস্করণ ডাউনলোড করুন পারফরম্যান্স থমসন এবং রাদারফোর্ড মডেলের অ্যাটম এর মধ্যে পার্থক্য।
রেফারেন্স:
1 "রটারফোর্ড মডেল অফ এটম: সংজ্ঞা এবং ডায়াগ্রাম " অধ্যয়ন. কম। এন। ঘ। ওয়েব। এখানে পাওয়া. 06 জুন ২017.
২। ব্রেসিসিয়া, ফ্রাঙ্ক রসায়ন বিষয়ক মূলধন: একটি আধুনিক ভূমিকা (1966)। এলসেভিয়ার, ২01২. মুদ্রণ করুন
3। গোল্ডসবি, কেনেথ রসায়ন. 12 তম সংস্করণ নিউ ইয়র্ক: ম্যাকগ্রা-পাহাড়, 2015. মুদ্রণ করুন।
চিত্র সৌজন্যে:
1 "প্লাম পুডিং এটম" (পাবলিক ডোমেইন) ওয়ার্ডপ্রেস উইকিমিডিয়া
২। "রাদারফোর্ড এটম" নিজের কাজ (তৈরি করুন জেডডের এক্সডি Xd) (সিসি বাই-এসএ 3। 0) কমনস উইমিকা উইকিমিডিয়া
3 "রাদারফোর্ড সোনার ফয়েল পরীক্ষার ফলাফল" ব্যবহারকারী: ফাস্টফিশন নিজের কাজ (পাবলিক ডোমেন) কমন্স মাধ্যমে উইকিমিডিয়া




