আল্কানে এবং আল্কিনের মধ্যে পার্থক্য | Alkanes বনাম Alkene
কী পার্থক্য - আলকেন বনাম আলকেনস
আলকানে এবং অ্যালকেনস দুটি ধরনের হাইড্রোকার্বন পরিবার যা তাদের আণবিক কাঠামোতে কার্বন এবং হাইড্রোজেন ধারণ করে। Alkanes এবং Alkenes মধ্যে কি পার্থক্য হল তাদের রাসায়নিক গঠন; অ্যালকেনগুলি হ্রাসকৃত হাইড্রোকার্বনগুলি C n H 2n + 2 এর সাধারণ আণবিক সূত্র দিয়ে গঠিত এবং অ্যালকেনগুলি একটি অসম্পৃক্ত হাইড্রোকার্বন গোষ্ঠী বলে মনে করা হয়, কারণ তারা দুটি কার্বনের মধ্যে একটি ডাবল বন্ড রয়েছে পরমাণু। তাদের সাধারণ আণবিক সূত্র C n h 2n থাকে।
আলকানে কি?
অ্যালকানে কার্বন এবং হাইড্রোজেন পরমাণুর (সি-সি বন্ড এবং সি-এইচ বন্ড) মধ্যে কেবল একক বন্ধন রয়েছে। অতএব, তাদেরকে "ভারসাম্যযুক্ত হাইড্রোকার্বন" বলা হয়। কক্ষীয় হাইব্রিডাইজেশন মডেলের মতে, অ্যালকেসে সব কার্বন পরমাণুগুলি SP 3 হাইব্রিডাইজেশন আছে। তারা হাইড্রোজেন পরমাণুর সাথে সিগমা বন্ড তৈরি করে, এবং ফলস্বরূপ অণুতে টেট্রাস্রড্র্রনের জ্যামিতি থাকে। আলেকানেস তাদের আণবিক ব্যবস্থা অনুসারে দুটি গ্রুপে বিভক্ত হতে পারে; Acyclic alkanes (C n h 2n। + 2 ) এবং চক্রাকার alkanes (সি n এইচ 2n )।

অ্যালকেস কি?
অ্যালকেনস হলো হাইড্রোকার্বন, যার মধ্যে রয়েছে কার্বন-কার্বন (সি = সি) ডাবল বন্ড। "ওলফিনস" এল্কিন পরিবারকে বোঝাতে ব্যবহৃত পুরাতন নাম। এই পরিবারের ছোট সদস্য ইথেন (সি ২ এইচ 4 ); প্রথম দিনগুলিতে এটি ওলফিয়ান টি গ্যাস (ল্যাটিন ভাষায়: ' ওলেম' অর্থ 'তেল' + 'মুখোমুখি' মানে 'তৈরি করা') বলা হয়। এটি C 2 এইচ 4 এবং ক্লোরিন C 2 এইচ 2 সিএল 2 এর মধ্যে প্রতিক্রিয়া দেয় কারণ, তেল.

অ্যালকানেস এবং অ্যালকেসের রাসায়নিক গঠন
আলকেনস:
আলকানে সাধারণ আণবিক সূত্র C n H 2n + 2 থাকে। মিথেন (CH 4 ) হল ক্ষুদ্রতম ক্ষুদ্রতম। - টেবিল থেকে প্রজেক্টের মধ্যবর্তী মধ্যম নিবন্ধ ->
নাম| রাসায়নিক সূত্র | এচিকিক গঠন | মিথেন |
| CH | 4 CH | 4 ইথেন সি |
| 2 | শু 6 সিএইচ 3 | সিএইচ 3 প্রোপেন সি |
| 3 | শু 8 সিএইচ 3 | সিএইচ 2 সিএইচ 3 রান্নার সি |
| 4 | শু 10 সিএইচ 3 সিএইচ | 2 সিএইচ 2 সিএইচ 3 পেন্টেন সি 5 |
| শু | 12 সিএইচ 3 সিএইচ | 2 সিএইচ 2 সিএইচ 2 সিএইচ 3 hexane সি 6 শু |
| 14 | সিএইচ 3 সিএইচ 2 | সিএইচ 2 সিএইচ 2 সিএইচ 2 সিএইচ 3 Heptane সি 7 শু |
| 16 | সিএইচ 3 সিএইচ 2 | সিএইচ 2 সিএইচ 2 সিএইচ 2 সিএইচ 2 সিএইচ 3 Octane সি 8 শু 18 |
| সিএইচ | 3 সিএইচ 3 সিএইচ | 2 সিএইচ 2 সিএইচ 2 সিএইচ 2 CH 3 CH 3 আলকেস: অ্যালকেনের সাধারণ রাসায়নিক সূত্র C n h 2n থাকে।অ্যালকেনসকে অসম্পৃক্ত হাইড্রোকার্বন বলে মনে করা হয়, কারণ হাইড্রোকার্বন অণু দ্বারা সর্বাধিক সংখ্যক হাইড্রোজেন পরমাণু থাকে না। |
নাম রাসায়নিক সূত্র গঠন Ethene C 2
| এইচ | 4 | CH |
| 2 = | CH ২ প্রোপেন সি | 3 এইচ 6 CH |
| 3 | CH = CH 2 বুনিন সি | 4 এইচ 8 CH |
| ২ = | CHCH 2 CH 3, | CH 3 CH = CHCH 3 Pentene সি 5 শু 10 সিএইচ 2 = |
| CHCH | 2 সিএইচ 2 CH | 3, CH 3 CH = CHCH 2 CH 3 হেক্সিন সি 6 এইচ 12 সিএইচ 2 = CHCH |
| 2 | সিএইচ 2 সিএইচ 2 | সিএইচ 3 সিএইচ 3 সিএইচ = CHCH 2 সিএইচ 2 সিএইচ 3 সিএইচ 3 সিএইচ 2 সিএইচ = CHCH 2
সিএইচ 3 Heptene সি 7 শু 14 সিএইচ = CHCH < 2 |
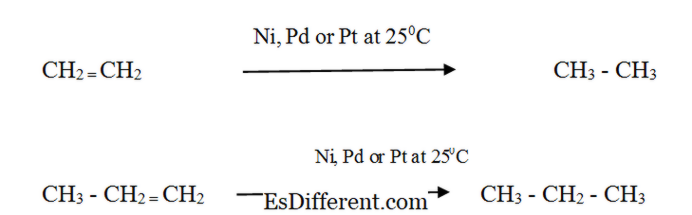
| সিএইচ | 2 সিএইচ 2 সিএইচ | 2 সিএইচ 3 সিএইচ 3 সিএইচ = সিএইচ < 2 CH 2 CH 2 CH 2 CH 3 অ্যালকানেস এবং অ্যালকেনের রাসায়নিক বৈশিষ্ট্য আলকেনস: প্রতিক্রিয়াশীলতা: অ্যালকানে অনেক রাসায়নিক পদার্থের সংমিশ্রণ হয়। কার্বন-কার্বন (সি-সি) এবং কার্বন-হাইড্রোজেন (সি-এইচ) বন্ধনগুলি বেশ শক্তিশালী কারণ কার্বন ও হাইড্রোজেন পরমাণুর প্রায় একই ইলেক্ট্রনগ্যাট্টিভিটি মান রয়েছে। অতএব, তাদের বন্ড ভাঙ্গা খুবই কঠিন, যতক্ষণ না তারা বেশিরভাগ উচ্চ তাপমাত্রায় উত্তপ্ত হয়। দহন: আলকেন বাতাসে সহজেই বার্ন করতে পারেন। অতিরিক্ত অক্সিজেন সহ আলকানেসের প্রতিক্রিয়া বলা হয় "জ্বলন"। এই প্রতিক্রিয়াতে, অ্যালকেন কার্বন ডাই অক্সাইড রূপান্তর (CO 2 ) এবং জল। সি n |
এইচ
২n + (n + n / 2) ও
2
→ n CO
2 +
nH 2 ও
সি 4 এইচ 10 + 13 / ২ ও ২ → 4 CO ২ + 5 এইচ 2 ও বেটেন অক্সিজেন কার্বন ডাইঅক্সাইড জল
জ্বলনের প্রতিক্রিয়া এক্সোওথেরিক প্রতিক্রিয়া (তারা তাপ বন্ধ করে দেয়)। ফলস্বরূপ, আলকেন শক্তি উৎস হিসাবে ব্যবহার করা হয়। আলকেস: প্রতিক্রিয়াশীলতা: অ্যালেকেনেসের একটি অনুপযুক্ত আলটেইন তৈরি করার জন্য একটি সূক্ষ্মভাবে বিভক্ত ধাতু অনুঘটকের উপস্থিতিতে হাইড্রোজেনের সাথে প্রতিক্রিয়া। প্রতিক্রিয়া হার একটি অনুঘটক ছাড়া খুব কম। মার্জারিন এবং কঠিন রান্নার চর্বি তৈরীর মধ্যে তরল উদ্ভিজ্জ তেল থেকে আধা-কঠিন চর্বি রূপান্তর খাদ্য শিল্পে ক্যালেটিকাল হাইড্রোজেনজাতকরণ ব্যবহার করা হয়। আলকানেস এবং অ্যালকেনেসের দৈহিক বৈশিষ্ট্যাবলী ফর্মগুলি আলকেনস: অ্যালকানে গ্যাস, তরল এবং কঠিন পদার্থ হিসাবে বিদ্যমান। মেথেন, ইথেন, প্রোপেন এবং বায়োটেন গ্যাসের কক্ষ তাপমাত্রায়। হেক্সেন, প্যান্টেন এবং হেপটেনের নিষিদ্ধ কাঠামো তরল হয়। একটি উচ্চ আণবিক ওজন আছে Alkanes solids হয়। CH 4
সি
4
এইচ
10
গ্যাসগুলি
সি
5
এইচ
1২ সি
17 এইচ 36 তরল, এবং উচ্চ আণবিক ওজন সঙ্গে আল্কেনস নরম কঠিন Alkenes: Alkenes সংশ্লিষ্ট Alkane অনুরূপ শারীরিক বৈশিষ্ট্য প্রদর্শন। Alkenes যা কম আণবিক ওজন (সি
2 এইচ 4 TOC 4 এইচ 8 ) কক্ষ তাপমাত্রা এবং বায়ুমণ্ডলীয় চাপ এ গ্যাস হয়।একটি উচ্চ আণবিক ওজন থাকার Alkenes solids হয়। দ্রাব্যতা:
আলকেনস:
আলকেন পানিতে দ্রবীভূত হয় না। তারা নন-পোলার বা দুর্বল পোলার জৈব দ্রাবকগুলির মধ্যে দ্রবীভূত হয়। আলকেস: সি-সি বন্ডের কারণে আলকেস অপেক্ষাকৃত পোলার অণু হয়; অতএব, তারা অ-পোলার সলভেন্ট বা কম প্রান্তিকতা দ্রবীভূত দ্রবণে দ্রবণীয় হয়। জল একটি মেরু অণু এবং alkenes জল সামান্য দ্রবণীয় হয়। ঘনত্ব: আলকেনস: আলকানের ঘনত্বের পানি ঘনত্বের চেয়ে কম। তাদের ঘনত্বের মান প্রায় 0. 7 গ্রাম এমএল -1 , 1.২ জি এমএল -1 হিসাবে ঘনত্বের পরিমাণ বিবেচনা করে।
আলকেস:
অ্যালকেনের ঘনত্বগুলি ঘনত্বের চেয়ে কম। ক্রমবর্ধমান বিন্দু:
আলকেনস: নির্বীজিত অ্যালকেনের উষ্ণ বিন্দু সহজভাবে কার্বন পরমাণুর সংখ্যা হিসাবে বৃদ্ধি পায় এবং আণবিক ওজন বাড়ছে। সাধারণভাবে, ব্র্যাঙ্কেড অ্যালকেনের কম সংখ্যক কার্বন পরমাণু থাকে, যার ফলে অরক্ষিত অ্যালকেনের তুলনায় উষ্ণতা কম থাকে।
আলিকেনস
: ক্রমবর্ধমান বিন্দুগুলির সাথে সামান্য পার্থক্য সহ সংশ্লিষ্ট অ্যালকেনের অনুরূপ। রেফারেন্সগুলি: ক্লিফ নোট (এন ডি।) 06 জুলাই, ২013 থেকে এখান থেকে উদ্ধার করা হয়েছে। আলাকানেসের ভৌত বৈশিষ্ট্যাবলী (2013)। 06 জুলাই, ২013 থেকে এখান থেকে উদ্ধার করা হয়েছে জুম ডাইরেক্টরি-মোডাস। (এন ডি।) 06 জুলাই, ২013 থেকে এখান থেকে উদ্ধার করা হয়েছে অ্যালকানেসের রাসায়নিক বৈশিষ্ট্য: উইজনিটস। com- বিনামূল্যে GCSE এবং CXC: টিউটোরিয়াল, অতীতের কাগজপত্র এবং ক্যুইজ। (এন ডি।) জুলাই 06, 2016 এ পুনরুদ্ধার, এখানে থেকে
পল্লারতা (এন ডি।) জুলাই 06, 2016 এ পুনরুদ্ধার, এখানে থেকে ডাইপোলের মুহুর্ত। (2013)। 06 জুলাই, ২013 থেকে এখান থেকে উদ্ধার করা হয়েছে
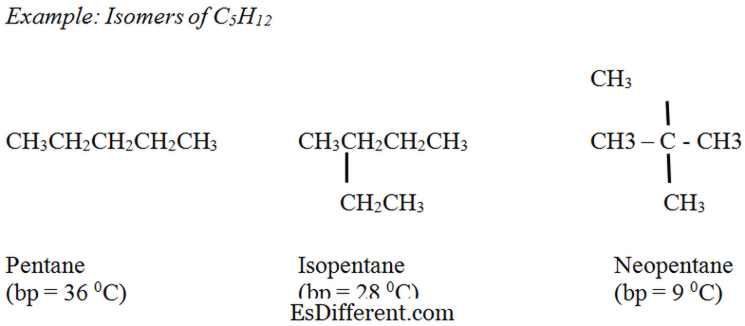
কাঠামোগত আইসোমার। (এন ডি।) 06 জুলাই, ২013 থেকে এখান থেকে উদ্ধার করা হয়েছে
অ্যালকেনের একটি ভূমিকা। (এন ডি।) পুনঃসংস্কার জুলাই 06, 2016 এখান থেকে চিত্র সৌজন্যে:
ক্রিস ইভান্স দ্বারা "আলকেইন নাম" - (CC0) কমিকস উইকিমিডিয়া "স্যাচুরাটেড সি 4 হাইড্রোকার্বন বল এবং স্টিক" ফাভাসকোলোস দ্বারা - নিজের কাজ (পাবলিক ডোমেইন) কমন্সে উইকিমিডিয়া


