অমমিনিয়াম নাইট্রেট এবং ইউরিয়া মধ্যে পার্থক্য
অ্যামোনিয়াম নাইট্রেট বনাম ইউরিয়া
নাইট্রোজেন ধারণকারী যৌগগুলি সাধারণত সার হিসাবে ব্যবহার করা হয় কারণ নাইট্রোজেনটি অত্যন্ত প্রয়োজনীয় উপাদানগুলির মধ্যে একটি। উদ্ভিদ বৃদ্ধি এবং উন্নয়ন। অ্যামোনিয়াম নাইট্রেট এবং ইউরিয়া যেমন নাইট্রোজেন ধারণকারী সলিড
অ্যামোনিয়াম নাইট্রেট
অ্যামোনিয়াম নাইট্রেট এনএইচ এর রাসায়নিক সূত্র আছে 4 না 3 । এটি অ্যামোনিয়া নাইট্রোজেন, এবং এর নিম্নোক্ত গঠনটি রয়েছে।

কক্ষ তাপমাত্রায় এবং স্ট্যান্ডার্ড চাপ এ ammonium nitrate একটি গন্ধহীন, সাদা স্ফটিক কঠিন হিসাবে বিদ্যমান। এটি একটি পিএইচ 5 এর সাথে একটি অদ্ভুত লবণ। 4. এর ডোনার ভর 80. 052 গ্রাম / মোল। অ্যামোনিয়াম নাইট্রেটের গলে যাওয়া বিন্দুটি প্রায় 170 ডিগ্রি সেন্টিগ্রেড এবং এটি গরম করার সময় প্রায় 210 × o সি। অ্যামোনিয়াম নাইট্রেট মূলত কৃষি উদ্দেশ্যে ব্যবহৃত হয়। এটি নাইট্রোজেন সমৃদ্ধ, তাই এটি একটি সার হিসাবে ব্যবহার করা হয়, উদ্ভিদের নাইট্রোজেন সরবরাহ। যেহেতু রাসায়নিক সঙ্গে তার সরাসরি যোগাযোগ বিপজ্জনক নয় এবং এটি বিষাক্ততা কম, এটি একটি সার হিসাবে ব্যবহার করার জন্য উপকারী। উপরন্তু, গরম বা ইগনিশন বিস্ফোরিত অ্যামোনিয়াম নাইট্রেট কারণ। অতএব, এটি বিস্ফোরক একটি অক্সিডেসিং এজেন্ট হিসাবে ব্যবহৃত হয়। এই বিস্ফোরক প্রকৃতির কারণে, যখন অ্যামোনিয়াম নাইট্রেট সংরক্ষণ করা আমাদের অতিরিক্ত সতর্কতা অবলম্বন করা উচিত। অ্যামোনিয়াম নাইট্রেট স্থিতিশীল, কিন্তু যখন এটি বিস্ফোরণের জন্য গলিত রাষ্ট্র ঝুঁকিতে হয় উচ্চতর হয়। তেল, ডিজেল, কাগজ, রাগ বা খড় হিসাবে অক্সিডিজেবল উপকরণ সঙ্গে যোগাযোগ আসে আসে ঝুঁকি বৃদ্ধি। অ্যামোনিয়াম নাইট্রেট উৎপাদন একটি সহজ রাসায়নিক প্রতিক্রিয়া। যখন নাইট্রিক এসিড অমোম্যানিয়া তরল প্রতিক্রিয়া হয়, সমাধান ফর্ম মধ্যে অ্যামোনিয়াম নাইট্রেট উত্পাদিত হয়। শিল্পোন্নতভাবে, কেন্দ্রীভূত নাইট্রিক অ্যাসিড এবং আম্মোনিয়া গ্যাস উত্পাদন জন্য ব্যবহৃত হয়। এটি একটি অত্যন্ত exothermic এবং সহিংস প্রতিক্রিয়া, এটি বৃহত আকারে এটি উত্পাদন চ্যালেঞ্জিং হয়। একটি লবণ হচ্ছে, অম্মোনীয় নাইট্র্রেট জল অত্যন্ত দ্রবণীয়। অতএব, এটি একটি সার হিসাবে ব্যবহার করা হয় যখন ধৌত করা এবং জলাশয়ে জমা হতে পারে। এটি জলজ জীবন জন্য একটি মারাত্মক অবস্থা হতে পারে। --২ ->
ইউরিয়াইউরিয়া CO (NH
2 ) 2 এবং নিম্নলিখিত কাঠামোটির আণবিক সূত্র আছে। এটি কার্যকরী গ্রুপ C = O এর সাথে একটি কার্বামাইড। দুটি NH
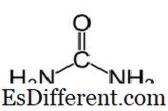
2 দুই পক্ষের থেকে কার্বনবিহীন কার্বন থেকে গ্রুপগুলি বন্ধ হয়ে যায়। ইউরিয়া প্রাকৃতিকভাবে নাইট্রোজেন বিপাক মধ্যে স্তন্যপায়ী উত্পাদিত হয়। এই ইউরিয়া চক্র হিসাবে পরিচিত হয়, এবং অ্যামোনিয়া বা অ্যামিনো অ্যাসিডের জারণ আমাদের দেহের ভিতরে ইউরিয়া উত্পাদন। কিডনি দিয়ে প্রস্রাবের মাধ্যমে ইউরিয়া বেশিরভাগই বিচ্ছিন্ন হয়ে যায় এবং কিছু কিছু ঘামের সাথে মিশে যায়। শরীর থেকে এটি excreting যখন ইউরিয়া উচ্চ জল দ্রাব্যতা সহায়ক। ইউরিয়া একটি বর্ণহীন, গন্ধহীন কঠিন, এবং এটি অ-বিষাক্ত। একটি বিপাকীয় পণ্য ছাড়াও, এর প্রধান ব্যবহার সার উত্পাদন হয়।ইউরিয়া সর্বাধিক নাইট্রোজেন সার নিষ্ক্রিয় এক, এবং এটি অন্য কঠিন নাইট্রোজেন সারের তুলনায় একটি উচ্চ নাইট্রোজেন সামগ্রী আছে। মাটিতে, ইউরিয়া অ্যামোনিয়া এবং কার্বন ডাই অক্সাইড রূপান্তরিত হয়। মাটি ব্যাকটেরিয়া দ্বারা এই অ্যামোনিয়া নাইট্রাইট রূপান্তরিত করা যায়। তাছাড়া ইউরিয়া নাইট্রেটের মত বিস্ফোরক উত্পাদন করার জন্য ইউরিয়া ব্যবহার করা হয়। এটি প্লাস্টিক এবং আঠালো মত রাসায়নিক উত্পাদন একটি কাঁচামাল হিসাবে ব্যবহার করা হয়।



