আইওনিক এবং সমবয়স যৌগিক মধ্যে পার্থক্য | আইওনিক বনাম কোওলান্টাল যৌগিক
কী পার্থক্য - আইওনিক বনাম কোওলান্টাল যৌগিক
অনেক পার্থক্য তাদের ম্যাক্রোস্কোপিক বৈশিষ্ট্যগুলির উপর ভিত্তি করে আইওনিক এবং সহস্রাব্দের সংমিশ্রনের মধ্যে উল্লেখ করা যেতে পারে যেমন দ্রাব্যতা জল, বৈদ্যুতিক পরিবাহিতা, গলনাঙ্ক এবং উঁচুমানের পয়েন্ট। এই পার্থক্য জন্য প্রধান কারণ তাদের বন্ধন প্যাটার্ন পার্থক্য। অতএব, তাদের বন্ধনের প্যাটার্ন এর মধ্যে পার্থক্য আইওনিক এবং সহস্রাব্দ যৌগ হিসাবে গণ্য করা যেতে পারে। (আইওনিক এবং কোওলালেন্ট বন্ডের মধ্যে পার্থক্য) যখন ইওনিক বন্ড গঠিত হয়, তখন ইলেকট্রন একটি ধাতু দ্বারা দান করা হয় এবং দানকৃত ইলেক্ট্রন একটি অ-ধাতু দ্বারা গৃহীত হয়। ইলেকট্রস্ট্যাটিক আকর্ষণের কারণে তারা একটি শক্তিশালী বন্ড গঠন করে। যৌথ বন্ড দুটি অ ধাতু-ধাতু মধ্যে গঠিত হয় যৌগিক বন্ধনে, অক্টেট নিয়মটি পরিপূর্ণ করার জন্য দুই বা ততোধিক পরমাণু ইলেকট্রনগুলি ভাগ করে নেয়। সাধারণত, আইওনিক বন্ডগুলি যৌথ বন্ডের চেয়ে শক্তিশালী। এই তাদের ভৌত সম্পত্তি পার্থক্য বাড়ে।
আইওনিক যৌগিক কি?
দুই ইলেকট্রনগ্যাট্টিটি মানগুলির মধ্যে দুটি পরমাণুতে বড় পার্থক্য থাকলে Ionic বন্ধন গঠিত হয়। বন্ড গঠন প্রক্রিয়ার মধ্যে, ইলেকট্রন (ইলেকট্রন) এবং ইলেকট্রনের (ইলেকট্রন) ইলেক্ট্রনগ্যাট্টিভ পরমাণুর কম ইলেক্ট্রোনগ্যাট্টিভ এটম হজ ক্ষতি। অতএব, ফলস্বরূপ প্রজাতিটি বিরোধিতা করে আওয়াজ আনে এবং শক্তিশালী ইলেকট্রস্ট্যাটিক আকর্ষণের কারণে তারা একটি বন্ড তৈরি করে।
--২ ->ধাতব এবং অ ধাতু-ধাতুগুলির মধ্যে আয়োজক বন্ড গঠিত হয়। সাধারণভাবে, বাইরের সর্বাধিক শেলের মধ্যে ধাতুগুলিতে অনেক বাহ্যিক ইলেকট্রন নেই; যাইহোক, অ ধাতু ঢালাই শেল আট ইলেকট্রন কাছাকাছি আছে। অতএব, অ ধাতুগুলি অক্টেট নিয়ম পূর্ণ করতে ইলেকট্রন গ্রহণ ঝোঁক।
ionic সংমিশ্রণের উদাহরণ না + + ক্লাঙ্ক - নাওক
সোডিয়াম (ধাতু) এর একমাত্র ভ্যালেন্স ইলেক্ট্রন এবং ক্লোরিন (অ-ধাতু) আছে সাত ভলিউম ইলেকট্রন

যৌথ যৌগিক কি?
"অক্টেট রুল" সন্তুষ্ট করতে দুই বা ততোধিক পরমাণুর মধ্যে ইলেকট্রন ভাগ করে যৌথ যৌগ গঠিত হয়। এই বন্ধন প্রকারটি সাধারণত অ-ধাতব যৌগগুলির মধ্যে পাওয়া যায়, এটি একই যৌগ বা পরমাণুগুলির আণবিকগুলি পর্যায় সারণিতে পাওয়া যায়। প্রায় একই ইলেকট্রনগ্যাট্টিভ মানগুলির দুটি পরমাণুগুলি তাদের ভ্যালেন্স শেল থেকে (দান / গ্রহন) ইলেকট্রন বিনিময় করে না। পরিবর্তে, তারা octet কনফিগারেশন অর্জন ইলেকট্রন ভাগ
সহস্রাব্দ যৌগসমূহের উদাহরণ হল মিথেন (CH 4 ), কার্বন মোনক্সাইড (CO), আইডাইন monobromide (IBr)
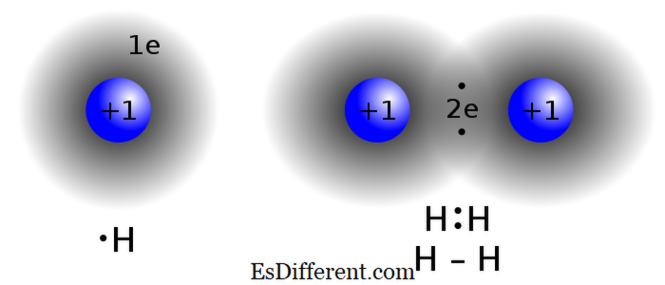
সহগামী বন্ডিং
আইওনিক এবং সহস্রাব্দের মধ্যে পার্থক্য কি? যৌগিক?
অ্যামোয়াক যৌগ এবং কোয়োলল্ট যৌগসমূহের সংজ্ঞা
অয়নীয় সংমিশ্রণ: অয়নিক যৌগ হচ্ছে একটি রাসায়নিক পদার্থ এবং আয়ন যা যৌগিক কাঠামোতে আঠালো বন্ধনী দ্বারা একত্রে রাখা হয়।
যৌগিক যৌগ: যৌগিক যৌগ একটি রাসায়নিক বন্ধন যা এক বা একাধিক ইলেকট্রন, বিশেষত ইলেকট্রনের জোড়া, এটমগুলির মধ্যে ভাগ করে।
আইওনিক এবং কোওলান্টাল যৌগগুলির বৈশিষ্ট্যগুলি
দৈহিক বৈশিষ্ট্যাবলী
আয়নিক যৌগিক:
সব আয়ন সংমিশ্রকগুলি কোষের তাপমাত্রায় দ্রাবক হিসাবে বিদ্যমান।
আয়োনিক যৌগগুলির একটি স্থিতিশীল স্ফটিক গঠন আছে। অতএব, তারা উচ্চ গলনাঙ্ক পয়েন্ট এবং ফুটন্ত পয়েন্ট আছে। ইতিবাচক ও নেতিবাচক আয়নগুলির মধ্যে আকর্ষণের বাহিনী খুবই শক্তিশালী।
- টেবিল থেকে বিভিন্ন প্রান্তের মধ্যবর্তী মধ্যম ->| আউনিক কম্পাউন্ড | চেহারা | মেলিং পয়েন্ট |
| NaCl - সোডিয়াম ক্লোরাইড | হোয়াইট স্ফটিকের কঠিন | 801 ডিগ্রি সেলসিয়াস |
| KCl - পটাসিয়াম ক্লোরাইড | হোয়াইট বা বর্ণহীন কাচের ক্রিস্টাল | 770 ° সি |
| এমজিএলসি ২ - ম্যাগনেসিয়াম ক্লোরাইড | সাদা বা বর্ণহীন স্ফটিকের কঠিন | 1412 ডিগ্রী সেলসিয়াস |
কোওলালটেনস কম্পাউন্ডস: যৌথ যৌগগুলি তিনটি রূপে বিদ্যমান; হিসাবে দ্রঢ়িমা, তরল এবং গ্যাসের কক্ষ তাপমাত্রায়।
তাদের গলন এবং উঁচু পয়েন্টগুলি ইওনিক যৌগের তুলনায় অপেক্ষাকৃত কম।
কোওলালটেনস কম্পাউন্ড
| চেহারা | গলে যাওয়া পয়েন্ট | এইচসিএল-হাইড্রোজেন ক্লোরাইড |
| একটি বর্ণহীন গ্যাস | -114 2 ° সি | CH |
| 4 -Methane একটি বর্ণহীন গ্যাস | -182 ° সে | CCl |
| 4 - কার্বন টেট্রাক্লোরাইড একটি বর্ণহীন তরল < -23 ° সি | পরিবাহিতা | আয়নিক যৌগিক: |
সলিড আইওনিক যৌগগুলির বিনামূল্যে ইলেকট্রন নেই; অতএব, তারা কঠিন আকারে বিদ্যুৎ সঞ্চালন করে না। কিন্তু, যখন ionic যৌগগুলি পানিতে দ্রবীভূত হয় তখন তারা একটি সমাধান করে যা বিদ্যুৎ সঞ্চালন করে। অন্য কথায়, আয়নীয় যৌগের জলের সমাধানগুলি ভাল বৈদ্যুতিক সংযোজক।
সহস্রাব্দ যৌগ: পানিতে নিঃসৃত যৌগিক সংমিশ্রণ বা দ্রবীভূত ফর্মগুলিও বিদ্যুৎ সঞ্চালন করে না অতএব, যৌগিক যৌগ সকল পর্যায়ে দরিদ্র বৈদ্যুতিক কন্ডাক্টর।
দ্রাব্যতা আয়নিক যৌগিক:
অধিকাংশ আয়নীয় যৌগ পানির মধ্যে দ্রবণীয় হয়, তবে অ-পোলার সলভেন্টসগুলিতে তারা অস্তরুল।
যৌগিক যৌগিক: বেশিরভাগ যৌগ যৌগগুলি অ-পোলার সলভেন্টে দ্রবীভূত হয়, কিন্তু পানিতে না।
কঠোরতা আয়নিক যৌগিক:
আইওনিক কঠিন কঠিন এবং ভঙ্গুর যৌগ।
সমবয়স যৌগ: সাধারনভাবে, যৌগিক যৌগগুলি ionic কঠিন বস্তুর তুলনায় নরম।
চিত্র সৌজন্যে: জেসেক এফএইচ দ্বারা "সহস্রাব্দ বন্ধন হাইড্রোজেন" - নিজের কাজ। (সিসি বাই-এসএ 3. 0) রোডের দ্বারা "আইওনিকব্যান্ডিংআরএইচ 11" কমনসন - নিজের কাজ। (সিসি বাই-এসএ 3. 0) উইকিমিডিয়া কমন্স মাধ্যমে


