জ্যামিতিক Isomers এবং কাঠামোগত Isomers মধ্যে পার্থক্য
জ্যামিতিক Isomers বনাম কাঠামোগত Isomers
Isomers একই আণবিক সূত্র সঙ্গে বিভিন্ন যৌগিক হয়। বিভিন্ন ধরনের isomers আছে। Isomers প্রধানত সাংবিধানিক isomers এবং stereoisomers হিসাবে দুই গ্রুপ বিভক্ত করা যাবে। সাংবিধানিক isomers isomers যেখানে অণুর সংযোগ অণু মধ্যে পার্থক্য। স্টেরিওওসোমারদের মধ্যে পরমাণুগুলি একই অনুক্রমের সাথে সংযুক্ত, সাংবিধানিক isomers ব্যতীত। স্টেরিওওসোমাররা কেবলমাত্র তাদের পরমাণুর স্থানব্যবস্থায়ই ভিন্নতা রাখে। Stereoisomers দুই ধরনের, enantiomers এবং diastereomers হতে পারে। Diastereomers stereoisomers হয়, যার অণু একে অপরের ইমেজ মিরর হয় না। Enantiomers stereoisomers হয়, যার অণু একে অপরের nonsuperposable মিরর ইমেজ হয়। Enantiomers chiral অণু সঙ্গে শুধুমাত্র ঘটতে একটি chiral অণু তার মিরর ইমেজ সঙ্গে অভিন্ন নয় যে এক হিসাবে সংজ্ঞায়িত করা হয়। অতএব, chiral অণু এবং তার মিরর ইমেজ একে অপরের Enantiomers হয়। উদাহরণস্বরূপ, 2-বিটিএনএনএল অণু হল চিরাল, এবং এটি এবং তার মিরর চিত্রগুলি এন্যানিয়েইওমরস।
জ্যামিতিক Isomers
জ্যামিতিক isomers স্টাইরিওসোমারদের একটি প্রকার। এই ধরনের isomers ফলাফল, যখন অণু একটি সীমাবদ্ধ ঘূর্ণন আছে, মূলত, একটি ডবল বন্ড কারণে। যখন একটি একক কার্বন-কার্বন বন্ড থাকে, তখন ঘূর্ণন সম্ভব হয়। অতএব, আমরা পরমাণু আঁকা, তাদের ব্যবস্থা একই হবে। কিন্তু যখন একটি কার্বন-কার্বন ডাবল বন্ড থাকে, তখন আমরা একটি অণুতে পরমাণুগুলির দুটি ব্যবস্থা আঁকতে পারি। ফলে isomers cis হিসাবে পরিচিত হয়, ট্রান্স isomers বা ই-Z isomers। সিআইএস আইজোমার এ একই ধরনের অণুর অণুর একই অংশ। কিন্তু ট্রান্স আইসোমারের মধ্যে, একই ধরনের অণুর অণুর বিপরীত দিকে থাকে। উদাহরণস্বরূপ, 1, 2-ডিক্লোরোইথেনের জন্য CIS এবং ট্রান্স স্ট্রাকচার নিম্নরূপঃ।
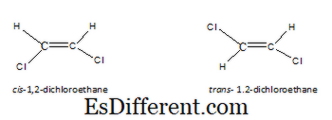
একটি অণুর জন্য জ্যামিতিক isomers আছে, এটি শুধুমাত্র একটি ডবল বন্ড আছে যথেষ্ট না শুধুমাত্র। ডাবল বন্ডের এক প্রান্তে সংযুক্ত দুটি পরমাণু বা গোষ্ঠীগুলি ভিন্ন হওয়া উচিত। উদাহরণস্বরূপ, নিম্নোক্ত অণুতে জ্যামিতিক অবজেক্ট নেই, বাম হাতের শেষের উভয় পারমাণু হাইড্রোজেন। যে কারণে, যদি আমরা এটি Cis বা ট্রান্স মধ্যে আঁকা, উভয় অণু একই।

কিন্তু চারটি সংযুক্ত গোষ্ঠী বা পরমাণুগুলি পৃথক কিনা তা কোন ব্যাপারই না। সেই সময়ে, আমরা তাদের নাম ই বা জেড হিসাবে উল্লেখ করতে পারি।
কাঠামোগত আয়রন
এইগুলিকেও সাংবিধানিক বিজয়ের হিসাবেও পরিচিত করা হয়। সাংবিধানিক isomers isomers, যেখানে অণুর সংযোগ অণু মধ্যে পার্থক্য। বেতনে সাংবিধানিক সমবায়ত্বকে দেখানোর জন্য সবচেয়ে সহজ সরল। বেতেনের দুই সাংবিধানিক বিস্ফোরণ আছে, নিজেই নিজেই এবং ইয়োবুতিন।

যেহেতু তাদের সংযোগগুলি আলাদা, দুটি অণু বিভিন্ন শারীরিক এবং রাসায়নিক বৈশিষ্ট্য আছে।স্ট্রাকচারাল isomers হাইড্রোকার্বন দ্বারা গঠিত হতে পারে যেখানে তাদের ন্যূনতম চারটি কার্বন পরমাণু আছে। কঙ্কাল, অবস্থানগত এবং কার্যকরী গ্রুপ isomers হিসাবে তিন ধরনের স্ট্রাকচারাল isomers আছে। উপরের উদাহরণে দেওয়া কঙ্কাল অস্তিত্ববাদে, কঙ্কালকে ভিন্ন ধরনের অ্যামোয়ামার প্রদানের জন্য পুনরায় সাজানো হয়। অবস্থান isomers, একটি কার্যকরী গ্রুপ বা অন্য গ্রুপ অবস্থান পরিবর্তন। কার্যকরী গ্রুপ isomers মধ্যে, যদিও তাদের একই সূত্র আছে, অণু বিভিন্ন কার্যকরী গ্রুপ থাকার পৃথক।
|
মধ্যে পার্থক্য কি জ্যামিতিক Isomers এবং কাঠামোগত Isomers ? • জ্যামিতিক আইসোমারগুলি স্টেরিওওওসোমারস। অতএব, কাঠামোগত isomers তুলনায় সেখানে সংযুক্তি একই হয়, where isomers পারমাণবিক সংযুক্তি কারণে আলাদা। জ্যামিতিক অবজেক্টের মধ্যে, তারা স্থান তিন মাত্রিক বিন্যাস কারণে পার্থক্য। • বেশিরভাগ অণুর জন্য Cis, trans বা E, Z হিসাবে দুটি জ্যামিতিক isomers আছে, কিন্তু একটি অণুর জন্য অনেকগুলি স্ট্রাকচারাল isomers হতে পারে। • জ্যামিতিক অবজেক্টিভ মূলত অণু দ্বারা কার্বন কার্বন ডাবল বন্ডের সাথে দেখানো হয়। কাঠামোগত isomerism যেমন alkanes, alkenes, alkynes এবং সুগন্ধযুক্ত যৌগিক দ্বারা দেখানো হয়, পাশাপাশি। |




