আংশিক চাপ এবং বাষ্প চাপ মধ্যে পার্থক্য
আংশিক চাপ এবং বাষ্প চাপ সাধারণত ব্যবহৃত হয় সিস্টেম উপাদান দ্বারা প্রযোজ্য চাপ পরিমাণের সাথে সম্পর্কিত বৈজ্ঞানিক পদ, কিন্তু তাদের পরিচয় অন্যদের বিভ্রান্তিকর হতে পারে। তাদের প্রভাব এবং পরিচয় সহ এই পদ মধ্যে একটি পরিষ্কার পার্থক্য আছে এই নিবন্ধটি এই শর্তাবলী মধ্যে পার্থক্য আরও বিস্তারিতভাবে ব্যাখ্যা করবে। এর মধ্যে তার প্রয়োগগুলি নিরস্ত করতে কিছু উদাহরণও অন্তর্ভুক্ত হবে।
আমরা বাষ্প এবং আংশিক চাপ মধ্যে পার্থক্য উপশম করতে পারেন আগে চাপ ধারণা হাইলাইট দ্বারা শুরু করা যাক। চাপ একটি বস্তু বা একটি পদার্থ প্রতি ইউনিট এলাকা প্রয়োগ হিসাবে বল বৈজ্ঞানিকভাবে সংজ্ঞায়িত করা হয়। এটি একে অপরের উপর colliding কণার দ্বারা প্রয়োগ করা বল হিসাবে সংজ্ঞায়িত করা যায় এবং এটি প্রায়ই পাসকাল দ্বারা পরিমাপ করা হয়। কণা সংঘর্ষের ক্ষেত্রে, গ্যাস সমীকরণ এবং গ্যাসের গণিত তত্ত্ব চাপের গণনা করতে ব্যবহৃত হয়।
--২ ->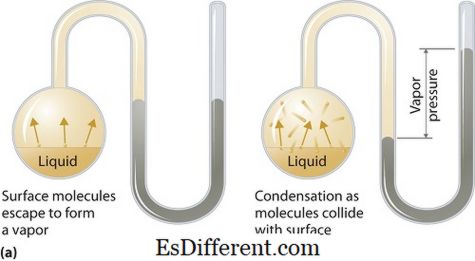
বাষ্প চাপ কি?
তরল বা কঠিন পর্যায়ে বাষ্প চাপ প্রয়োগ করতে পারে। তরঙ্গ বা তরল (কঠিন) উভয় যোগাযোগ যখন একটি বদ্ধ সিস্টেম একটি প্রদত্ত তাপমাত্রায় তার তরল বা কঠিন অবস্থা উপর তার তাপবিদ্যায় সামঞ্জস্য মধ্যে বাষ্প দ্বারা প্রবল চাপ হয়। এই চাপ বাষ্পীভবনের ফলে উদ্ভূত হয়, যা কঠিন বা তরল উপর একটি বৃদ্ধি তাপ দ্বারা সক্রিয় করা হয়। সুতরাং তাপমাত্রা বাষ্পীভবনের পরিমাপ হিসাবে ব্যবহৃত হয় এবং এটি তরল চাপের সরাসরি সমানুপাতিক। এর মানে, তাপমাত্রা বেশি হলে বাষ্প চাপ বেশি হয়।
বাষ্পীভবনের সময়, বায়ু অণু একটি বন্ধ সিস্টেমের মধ্যে উচ্চ গতিসম্পন্ন শক্তির ফলে বাতাসে অব্যাহতি পায়। তারপর যখন ভারসাম্যপূর্ণ অবস্থায়, বাষ্প এবং তরল (ঘন) এর ঘনীভূত ফর্ম এর মধ্যে বাষ্প চাপ দেখা দেয়। সমাধান যেখানে অন্তর্বর্তী বাহিনী দুর্বল হয়, বাষ্পের চাপ বেশি হতে পারে, এবং এর বিপরীতে, সমাধানগুলি যেখানে আন্তঃধর্মীয় বাহিনী শক্তিশালী, সেখানে বাষ্প চাপ কম।
রাওল্টের আইন দ্বারা ব্যাখ্যা করা হিসাবে আদর্শ মিশ্রণে বাষ্প চাপও হতে পারে। এটি বলে যে তরল বা কঠিন মিশ্রণের একটি নির্দিষ্ট উপাদানের আংশিক বাষ্পের চাপ একটি প্রদত্ত তাপমাত্রায় তার মিশ্রণের ভগ্নাংশ দ্বারা গুণিত হয় সেই কম্পোনেন্টের ভাপ চাপের সমান। নীচের উদাহরণটি ব্যাখ্যা করবে।
উদাহরণ 1.
0 একটি আদর্শ মিশ্রণ দেওয়া। 5 mol। ইথানল এবং 1. 5 mol 30KPa এবং 52KPa এর vapor চাপ সঙ্গে মথানল, যথাক্রমে, প্রতিটি উপাদান এর আংশিক বাষ্প চাপ নির্ধারণ।
সমাধান:
মোলস মোট সংখ্যা 1. 5mol + 0. 5mol = 2. 0mol। রাউল্টের আইন অনুযায়ী, আংশিক বাষ্প চাপ সেই বিশেষ কম্পোনেন্টের মোলার ভগ্নাংশের দ্বারা গাঁজন বাষ্পের চাপের সমান।এই ক্ষেত্রে, পি মেথানল = 1. 5/2 * 52 = 39 কেপিএ এবং পি এথানল = 0. 5/2 * 30 = 7. 5 কেপিএ।
মিশ্রণের অংশগুলির আংশিক বাষ্পের চাপ থাকলে, আপনি তাদের একসঙ্গে যোগ করে মোট বাষ্প চাপ পেতে পারেন। এই প্রসঙ্গে, 7. 5 + 39 46. 5 কেপিএ এথানল এবং মেথানলের সমাধান মিশ্রণের মোট বাষ্প চাপ।
বাষ্পের চাপকে প্রভাবিত করে এমন ফ্যাক্টর
অণুর পরিচয়
উপরে উল্লিখিত হিসাবে ইতিমধ্যেই, আণবিক বাহিনী ধরনের বায়ু চাপ প্রসার করা পরিমাণ নির্ধারণ। যদি বাহিনী শক্তিশালী হয়, তবে কম বাষ্প চাপ উত্থাপন করে, এবং দুর্বল হলে, আরো বাষ্পের চাপ দেখা দেয়। অতএব, তরল বা শক্তির গঠন বাষ্প চাপ প্রভাবিত করবে।
তাপমাত্রা
উচ্চ তাপমাত্রা উচ্চতর বাষ্পের চাপে বাড়ে কারণ এটি আণবিক বাহিনী ভাঙার জন্য আরও গতিশীল শক্তি সক্রিয় করে যাতে অণু তরল পৃষ্ঠ থেকে দ্রুত পালিয়ে যায়। যখন বাষ্পের চাপ (স্যাচুরেটেড বাষ্প চাপ) বহিরাগত চাপ (বায়ুমণ্ডলীয় চাপ) সমান করে তখন তরল ফোঁড়া শুরু হবে। একটি নিম্ন তাপমাত্রা কম বাষ্প চাপ ফলে এবং এটি তরল উষ্ণ জন্য সময় লাগবে।

ডাল্টনের আংশিক চাপের আইন
আংশিক চাপ কি?
আংশিক চাপের ধারণাটি প্রথমে প্রখ্যাত বিজ্ঞানী জন ডাল্টন কর্তৃক প্রস্তাবিত। এটি তার আংশিক চাপের আইন প্রবর্তন করে যা বলে যে গ্যাসের আদর্শ মিশ্রণ দ্বারা উত্পন্ন মোট চাপ পৃথক গ্যাসের আংশিক চাপের সমান। বলুন একটি নির্দিষ্ট ধারক হাইড্রোজেন, নাইট্রোজেন এবং অক্সিজেন গ্যাস দ্বারা পূর্ণ, পি মোট, অক্সিজেন, নাইট্রোজেন এবং হাইড্রোজেন সমান সমান হবে। যে মিশ্রণে কোনও গ্যাসের আংশিক চাপ গণনা করে ব্যক্তিগত গ্যাসের দড়ি ভগ্নাংশ দ্বারা মোট চাপের সংখ্যা গণনা করে।
সংক্ষিপ্তভাবে, আংশিক চাপ মিশ্রণে একটি বিশেষ গ্যাস দ্বারা প্রযোজ্য চাপ যেমন যদি এটি সিস্টেমের মধ্যে একা অভিনয় হয়। সুতরাং একটি পৃথক গ্যাস আংশিক চাপ নির্ণয় যখন আপনি অন্যান্য গ্যাস অগ্রাহ্য। এই তত্ত্ব ইনজেকশন দ্বারা, যাচাই করা যায়, 0. 0. 6 টটম অফ ও 2 10 এর মধ্যে। 0 কিলোমিটারের মধ্যে একটি 230 কে এবং তারপর ইনজেক্টিং 0। 4 টা এন 2 একটি অভিন্ন ধারক একই তাপমাত্রা একই আকার, এবং তারপর শেষ পর্যন্ত গ্যাস মোট চাপ পরিমাপ; এটি দুটি গ্যাসের সমষ্টি হবে। এটি স্পষ্টভাবে অ প্রতিক্রিয়াশীল গ্যাস মিশ্রণের একটি পৃথক গ্যাস আংশিক চাপ ব্যাখ্যা।
আংশিক চাপ গণনা করা
ডাল্টনের আইন [1] থেকে আংশিক চাপ নিরূপণ করার জন্য একটি সম্পূর্ণ বাতি হয় যাতে এটির বিধান রয়েছে। এটি প্রদত্ত সাধারণত তথ্য নির্ভর করবে। উদাহরণস্বরূপ, যদি গ্যাস A এবং B এর সংমিশ্রিত গ্যাস A এর চাপের জন্য মোট চাপ দেওয়া হয় তবে B এর আংশিক চাপ P TOTAL = P ব্যবহার করে গণনা করা যেতে পারে। একটি + পি বি । বাকি বীজগাণিতিক ম্যানিপুলেশন। কিন্তু এমন একটি ক্ষেত্রে যেখানে মিশ্রণের মোট চাপ দেওয়া হয়েছে, আপনি ডিফল্ট গ্যাস বিলের দড়ি ভগ্নাংশটি ব্যবহার করতে পারেন তা হল আংশিক চাপ।গ্যাস মিশ্রণের মোট moles দ্বারা গ্যাস বি এর moles বিভাজক দ্বারা X দ্বারা চিহ্নিত দড়ি ভগ্নাংশ, পাওয়া যায়। তারপর আংশিক চাপ খুঁজে বের করার জন্য, আপনি পুরো চাপ দ্বারা দড়ি ভগ্নাংশ, এক্স, বাড়িয়ে তুলবেন। নীচের উদাহরণটি বিশদ ব্যাখ্যা করে
উদাহরণ 2.
নাইট্রোজেন এবং অক্সিজেনের মিশ্রন, ২.5 মোলস এবং 1. 85 মোল্জ, যথাক্রমে ২0। ২4 কিলোমিটারের মধ্যে 4 কিলোমিটারের মোট চাপে ইনজেক্ট করা হয়; অক্সিজেন গ্যাস দ্বারা exerted আংশিক চাপ গণনা।
সমাধান:
মিশ্রণে মোট মোলস সংখ্যা 2. 5 + 1. 85 = 4. 35 moles। তাই অক্সিজেনের মর্ষের ভগ্নাংশ, এক্স ও , 1. 85 moles / 4 হবে। 35 moles = 0. 425 moles। অক্সিজেনের আংশিক চাপ 0 হতে হবে। 4২5 * 4 টা = 1. 7 টা। অবশিষ্ট গ্যাসের আংশিক চাপ একই পদ্ধতি অনুসরণ করে গণনা করা যেতে পারে বা অক্সিজেন গ্যাস এবং ডাল্টন আংশিক চাপের আইন দ্বারা প্রসারিত হিসাবে মোট চাপ দ্বারা গণনা করা যেতে পারে যে অ প্রতিক্রিয়াশীল গ্যাসের মোট চাপ সমষ্টি সমান হয় আংশিক চাপ।
বাষ্প এবং আংশিক চাপ মধ্যে পার্থক্য
উপরে ব্যাখ্যা থেকে, এটা স্পষ্ট যে ভাপ চাপ এবং আংশিক চাপ দুটি স্বতন্ত্র চাপ। বাষ্প চাপ তরল এবং কঠিন পর্যায়ে প্রযোজ্য যখন আংশিক চাপ গ্যাসীয় পর্যায়ে প্রযোজ্য। ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে ধীরে উজ্জ্বলতা যোগ করা হয়।
আংশিক চাপ এবং বাষ্প চাপের মধ্যে প্রধান পার্থক্য হল আংশিক চাপ একটি পৃথক গ্যাস দ্বারা মিশ্রণে চাপ প্রয়োগ করে যেমনটি এককভাবে একই পদ্ধতিতে থাকে, যখন ভাপের চাপ তার মধ্যে বাষ্প দ্বারা চাপিত চাপ বোঝায় তরল বা কঠিন এর ঘন অবস্থা সঙ্গে thermodynamic সাম্যবিশ্লেষণ নীচের টেবিলের এই চাপ একটি সংক্ষিপ্ত তুলনা দেয়।
| ভাপের চাপ | আংশিক চাপ |
| তরল বা কঠিন বাষ্প দ্বারা বায়ুমন্ডলে তার ঘনীভূত ফেজে এটি প্রবাহিত হয় | এটি একটি অ প্রতিক্রিয়াশীল গ্যাস মিশ্রণে পৃথক গ্যাস দ্বারা প্রযোজ্য হয় |
| রয়্যাল্টের আইন | ভাল ডল্টন এর আইন দ্বারা ব্যাখ্যা |
| কঠিন এবং তরল পর্যায়ে প্রযোজ্য | গ্যাসীয় পর্যায়ে শুধুমাত্র প্রয়োগ |
| পৃষ্ঠ এলাকা বা সিস্টেমের ভলিউম স্বাধীন | একই গ্যাস ব্যবহার গণনা ভলিউম |
| সলিউশনের মোল ভগ্নাংশ ব্যবহার করে গণনা করা | গ্যাসের মোল ভগ্নাংশ ব্যবহার করে গণনা করা |
মোড়ানো!
বাষ্প চাপ এবং আংশিক চাপ দুটি গুরুত্বপূর্ণ বৈজ্ঞানিক শব্দ ব্যবহৃত হয় বিশেষত তাপমাত্রার উপর বন্ধ সিস্টেম দেওয়া যথাক্রমে বাষ্প এবং গ্যাস দ্বারা প্রয়োগ করা বাহিনীর প্রভাব নির্ধারণে ব্যবহৃত। তাদের প্রধান পার্থক্য হল তরল বা কঠিন পদার্থের উপর প্রয়োগ করা বাষ্পের চাপের প্রয়োগ এলাকা, যেখানে একটি নির্দিষ্ট পরিমাণে আদর্শ গ্যাসের মিশ্রণে আংশিক চাপ একটি পৃথক গ্যাস প্রয়োগ করা হয়।
ডাল্টনের আংশিক চাপের আইন অনুসরণ করে আংশিক চাপ সহজে গণনা করা হয়, তবে ভাপের চাপ রাউল্টের আইন প্রয়োগ করে হিসাব করা হয়।যে কোনো মিশ্রণে, প্রতিটি গ্যাস কম্পোনেন্ট তার নিজস্ব চাপ বহন করে, যা অন্য গ্যাসের থেকে পৃথক আংশিক চাপ বলে। এবং আপনি তাপমাত্রা অবশিষ্ট ধ্রুবক সঙ্গে কোন উপাদান moles ডবল যখন, আপনি তার আংশিক চাপ বৃদ্ধি করা হবে। ক্লাউসিয়াস-ক্লাপায়ারন সম্পর্ক অনুসারে [2], তাপমাত্রা বৃদ্ধির সাথে বাষ্পের চাপ বৃদ্ধি পায়।
উপরে উল্লিখিত তথ্য দিয়ে, আপনি ভাপ চাপ এবং আংশিক চাপ মধ্যে পার্থক্য করতে সক্ষম হওয়া উচিত। আপনি মস্তলগত ভগ্নাংশ ব্যবহার করে গণনা করতে সক্ষম হবেন এবং মোট চাপ দ্বারা গুণিত হবেন। এই চাপ প্রয়োগের জন্য আমরা আপনাকে সাধারণ উদাহরণ দিয়েছি।


