অক্টোট এবং ডুপ্লেট মধ্যে পার্থক্য | Octet বনাম Duplet
কী পার্থক্য - অক্টেট বনাম ডুপ্লেট
রাসায়নিকভাবে সক্রিয় এবং নিষ্ক্রিয় পরমাণু বা প্রকৃতির যৌগ বিদ্যমান। এই চরিত্রগত প্রধানত পরমাণু বাইরের সর্বোচ্চ শেল উপস্থিত ইলেকট্রন সংখ্যা উপর নির্ভরশীল। স্থিতিশীল হওয়ার জন্য ইলেক্ট্রন কনফিগারেশন সম্পূর্ণ করার জন্য পরমাণুগুলি অসম্পূর্ণ শেলগুলির সক্রিয় হতে পারে নিষ্ক্রিয় যে পরমাণু একটি সম্পূর্ণ ইলেক্ট্রন কনফিগারেশন আছে; এইভাবে, এই পরমাণু অন্য কোন পরমাণুর সাথে প্রতিক্রিয়া না করে যতক্ষণ না বিশেষ অবস্থায়। নোবল গ্যাস সবসময় প্রকৃতির মধ্যে নিষ্ক্রিয়। অতএব, তারা নিষ্ক্রিয় গ্যাস হিসাবে পরিচিত। ইনিশিয়াল গ্যাসগুলি আর্কাইভ টেবিলে আটটি কলামে রয়েছে। একই সময়ে (সারি) অন্যান্য উপাদান যে সময়ের শেষে অযৌক্তিক গ্যাসের ইলেকট্রন কনফিগারেশন প্রাপ্ত ঝোঁক, যা প্রকৃতির সবচেয়ে স্থিতিশীল ফর্ম। সক্রিয় পরমাণুগুলি অক্টেট নিয়ম বা দ্বিগুণ নিয়ম অনুসারে ইলেক্ট্রন সংখ্যা সম্পূর্ণ করতে থাকে। Octet এবং duplet এর মূল পার্থক্য হল যে octet একটি পরমাণু বা একটি আয়ন যার সর্বোচ্চ সর্বোচ্চ আটটি ইলেকট্রন রয়েছে যখন দ্বৈত বাইরের সর্বোচ্চ শেল ।
সুচিপত্র
1। সংক্ষিপ্ত বিবরণ এবং কী পার্থক্য
2 একটি অক্টোট
3 কি একটি ডুপ্লেট কি
4 সাইড তুলনা দ্বারা সাইড - অক্টেট বনাম Duplet
5 সারাংশ
একটি অক্টোট কি?
একটি অক্টেট হল একটি পরমাণু বা একটি আয়ন যা এই পরমাণুর বাইরের সর্বোচ্চ শেলের আটটি ইলেকট্রন ধারণ করে। হিলিয়াম ব্যতীত সব উত্তম গ্যাস আটটি ইলেকট্রন আছে এবং প্রকৃতির অকার্যকর। একটি উত্তম গ্যাস ইলেক্ট্রন কনফিগারেশন সর্বদা হিসাবে শেষ হবে নিম্নরূপ।
উদাহরণস্বরূপ, নিওনের ইলেকট্রন কনফিগারেশন হল 1s2 2s 2
ns 2 2p 6 । নিওন একটি নিষ্ক্রিয় গ্যাস। সাত, ছয়, ইত্যাদি অন্যান্য উপাদানের বাইরের বাইরের ইলেকট্রনগুলিতে ইলেকট্রন বাইরের ইলেকট্রনগুলি পাওয়ার দ্বারা অক্টেট নিয়ম মেনে চলতে থাকে; ইলেকট্রন ইলেকট্রন হারান এবং নিকটবর্তী অণুর গ্যাসের ইলেক্ট্রন কনফিগারেশন প্রাপ্তির জন্য কিছু ইলেকট্রন রয়েছে। কিন্তু পর্যায় সারণির মধ্যবর্তী অন্যান্য উপাদানগুলি ইলেকট্রনগুলি ভাগ করার জন্য ইলেক্ট্রন ধারণ করার উপাদানগুলির সাথে নতুন বন্ড তৈরি করবে এবং একটি অক্টেট হয়ে যাবে।
চিত্র 01: নিওন, একটি অক্টেট
একটি ডুপ্লেট কি?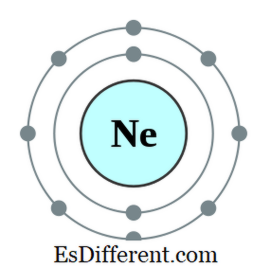
হাইড্রোজেন পরমাণু এবং হিলিয়াম পরমাণুর প্রকৃতির ক্ষুদ্রতম উপাদান এবং তাদের নিউক্লিয়াসের মধ্যে কেবলমাত্র একটি কক্ষপথ রয়েছে। এই কক্ষপথ 1s কক্ষপথ বলা হয়। এই কক্ষপথে সর্বোচ্চ দুটি ইলেকট্রন থাকতে পারে। হাইড্রোজেন পরমাণুতে এক ইলেক্ট্রন এবং হিলিয়ামের দুটি ইলেকট্রন রয়েছে। অতএব, হিলিয়াম একটি duplet বলা হয়।হিলিয়ামের সর্বোচ্চ সংখ্যক ইলেকট্রন রয়েছে; এইভাবে এটি প্রকৃতির একটি স্থিতিশীল উপাদান। অতএব, হিলিয়ামও একটি নিষ্ক্রিয় গ্যাস। কিন্তু হাইড্রোজেনের একমাত্র ইলেকট্রন রয়েছে এবং এটি কেবলমাত্র অসম্পূর্ণ। এইভাবে, শুধুমাত্র হাইড্রোজেন পরমাণুগুলি খুব প্রতিক্রিয়াশীল এবং এটি তাদের একমাত্র ইলেকট্রন ভাগ করে অন্য হাইড্রোজেন পরমাণুর সাথে একটি যৌথ বন্ধন গঠন করতে থাকে। তারপর এই হাইড্রোজেন পরমাণু duplets হয়ে ওঠে কারণ এখন তাদের বাইরের সর্বোচ্চ অক্ষাংশে দুটি ইলেকট্রন আছে। কিন্তু লিথিয়াম বাইরের সর্বোচ্চ কক্ষপথ থেকে ইলেক্ট্রনকে সরিয়ে ফেলার মাধ্যমে দ্বিগুণ হিসাবে আচরণ করতে পারে। লিথিয়ামের ইলেকট্রন কনফিগারেশনটি 1s
2
2s 1 । 2s 1 ইলেক্ট্রনটি অপসারণ করে, এটি একটি দ্বিগুণ হতে পারে। এই ক্ষেত্রে, তিনি, এইচ - এবং লি + অনুরূপ দ্বিধান্বিত যেগুলি স্থিতিশীল অনুরূপ হিসাবে বিদ্যমান হতে পারে। সমস্ত দ্বিতলগুলি ইলেক্ট্রন কনফিগারেশন শেষ করে নিম্নরূপ। ns
2
চিত্র 02: হিলিয়াম, একটি অনুরূপ অক্টোট এবং ডুপ্লেট মধ্যে পার্থক্য কি?

- টেবিল থেকে বিভিন্ন প্রান্তের মধ্যম ->
অক্টেট বনাম ডুপ্লেট
অক্টোটের বাইরের সর্বোচ্চ শেলের আটটি ইলেকট্রন আছে।
ডুপ্লেট বাইরের সর্বোচ্চ শেলের দুটি ইলেকট্রন আছে। |
|
| সাধারণ ইলেক্ট্রন কনফিগারেশন | অক্টোটের এনএস |
| ২ | |
| এনপি 6 শেষে ইলেক্ট্রন কনফিগারেশন টাইপ করুন। ডুপ্লেটের এনএস ২ | শেষে কনফিগারেশন টাইপ করুন অরবিটগুলির সংখ্যা অক্টোটের মধ্যে কমপক্ষে দুটি অরবিটাল থাকতে পারে। |
| একটি দ্বিগুণ শুধুমাত্র একটি কক্ষপথ আছে। | |
| অরবিটেলের ধরন | একটি অক্টেটে সব ধরণের অরবিটাল থাকতে পারে যেমন যেমন s, p, d, f, ইত্যাদি। |
| ডুপ্লেটের কেবলমাত্র কক্ষপথই আছে | |
| সারসংক্ষেপ - অক্টেট বনাম ডুপ্লেট | সব উপাদান স্থিতিশীল হতে থাকে কিন্তু অসম্পূর্ণ ইলেক্ট্রন কনফিগারেশনের সাথে পরমাণু স্থিতিশীল হতে পারে না; এইভাবে, তারা ইলেক্ট্রন হারানো বা ভাগ করে ইলেকট্রনের সাথে শেলগুলি পূরণ করার জন্য খুব প্রতিক্রিয়াশীল হয়ে উঠছে। অক্সেট বা দ্বিগুণ নিয়ম মানানসই পরমাণু বা অণু স্থিতিশীল। অক্টেট এবং ড্যুলেটের মধ্যে পার্থক্যটি হল, আটটি ইলেকট্রন তার বাইরের সর্বোচ্চ কক্ষপথে রয়েছে এবং ডুপ্লেট তার কক্ষপথে দুটি ইলেকট্রন আছে। |
রেফারেন্সগুলি:
1। নামা, পি, ২011। টপপারলিনারিং [অনলাইন] এখানে পাওয়া যায়: // www। topperlearning। com / ফোরাম / হোম-ওয়ার্ক-হেল্প -19 / কি-টু-অক্টেট-ড্যুলেট-ভ্যালেন্সিশন-এবং-আয়ন-রসায়ন-কাঠামোর কাঠামো-এর-এটম-46317 / উত্তর [অ্যাক্সেস করা হয়েছে ২9 05 2017]।
2। চ্যাং, আর।, ২010। রসায়ন 10 ই ই আগ। নিউ ইয়র্ক: ম্যাকগ্রা-হিল
3। বেনামা।, 2015. গ্রেড স্টকার। [অনলাইন] এ উপলব্ধ: // gradestack। কম / এনটিএসই-সম্পূর্ণ-কোর্স / কেমিক্যাল-বন্ডিং / কেমিক্যাল-অ্যাক্টিভিটি-অফ-এ / 19176-3853-37737-স্টাডি-ওয়াটডব [অ্যাক্সেসকৃত ২9 শে 057২7]
চিত্র সৌজন্যে:
1 "ইলেক্ট্রন শেল 002 হিলিয়াম - কোন লেবেল" পাম্পা দ্বারা (গ্র্যাগ রব্সন কর্তৃক মূল কাজ) - ইলেক্ট্রন শেল ডায়াগ্রামস (সংশ্লিষ্ট লেবেলকৃত সংস্করণ) (সিসি বাই-এসএ ২. 0 ইউকে) কমন্স দ্বারা উইকিমিডিয়া
২। "ইলেক্ট্রন শেল 010 নেওন" পাম্পা দ্বারা (গ্র্যাগ রব্সন দ্বারা মূল কাজ) (সিসি বাই-এসএ ২. 0 ইউকে) কমন্স মাধ্যমে উইকিমিডিয়া


